Bạn đang được gặp gỡ trở ngại lúc học cho tới số mol, độ đậm đặc mol, độ đậm đặc Xác Suất vô môn Hóa Học trung học tập hạ tầng thì nội dung bài viết sau đây của Shop chúng tôi sẽ hỗ trợ chúng ta ôn tậm lại những công thức tính số mol, công thức tính độ đậm đặc mol và công thức tính độ đậm đặc phần trăm không hề thiếu, cụ thể.
Số mol được kí hiệu là chữ n và nhằm tính được số mol những bạn cũng có thể vận dụng những công thức tính sau đây Shop chúng tôi share chúng ta coi ngay lập tức.
Bạn đang xem: Công thức tính số mol, Nồng độ mol, Nồng độ phần trăm chính xác 100%
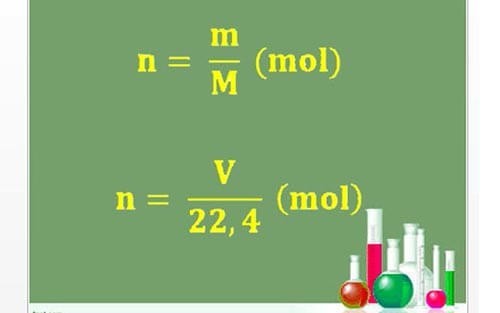
1. Cách tính số mol vẹn toàn tử, phân tử theo đuổi khối lượng
n = m/M
Trong bại liệt :
- n là số mol hóa học (mol).
- M là lượng mol (g/mol): Là lượng mol của hóa học bại liệt tính rời khỏi gam của N phân tử hoặc vẹn toàn tử hóa học bại liệt. Khối lượng mol có mức giá trị vì như thế phân tử khối hoặc phân tử khối của hóa học bại liệt như lượng mol vẹn toàn tử cacbon – C là 12 g/mol, lượng mol của phân tử amoniac – NH3 là 17 g/mol.
Các bạn phải xem xét rằng, lượng mol của vẹn toàn tử và phân tử là rất khác nhau. Ví dụ, lượng mol của phân tử Nito – N2 là 28 g/mol còn lượng mol của vẹn toàn tử Nito – N là 14 g/mol - m là lượng của hóa học bại liệt (g).
2. Cách tính số mol của hóa học khí ở ĐK chi chuẩn chỉnh (đktc)
n = V/22,4
Trong bại liệt :
- n là số mol hóa học khí (mol).
- V là thể tích hóa học khí ở ĐK chi chuẩn chỉnh (lít).
- 22,4 là hằng số vô ĐK chi chuẩn chỉnh.
Đối với tình huống hóa học khí ở hiện trạng bất ngờ, ĐK không giống với ĐK chi chuẩn chỉnh, chúng ta ko thể dùng công thức bên trên nhưng mà nên cần thiết cho tới những công thức và luật lệ tính phức tạp rộng lớn.
Công thức tính độ đậm đặc mol
CM = n/V
Trong bại liệt :
- CM Nồng phỏng mol
- n số mol hóa học tan
- V thể tích dung dịch
Lý giải: Nồng phỏng mol thông qua số mol hóa học tan phân chia mang lại thể tích hỗn hợp.
Công thức tính độ đậm đặc phần trăm
C% = mct/mdd x 100%
Trong đó:
- C%: Nồng phỏng phần trăm
- mct: Khối lượng hóa học tan
- mdd: Khối lượng dung dịch
Mặt khác: mdd = mct + mdm (mdm là lượng của dung môi)
Lý giải : Nồng phỏng Xác Suất vì như thế lượng hóa học tan phân chia mang lại lượng hỗn hợp và nhân với cùng 1 trăm Xác Suất.
Bài tập dượt về công thức tính số mol, độ đậm đặc mol và độ đậm đặc Xác Suất sở hữu đáp án
Bài tập dượt 1: Cho 14,4 lít nước hãy tính độ đậm đặc mol của hỗn hợp Khi hòa tan không còn trọn vẹn 31,6g KMnO4 vô đó
Lời giải:
Ta sở hữu số mol của KMnO4 là:
nKMnO4 = 31,6/15,8=0,2 (mol)
Nồng phỏng mol của hỗn hợp được xem là : Cm=0,2/31,6=0,0139
Bài tập dượt 2: Tính độ đậm đặc mol của hỗn hợp Khi hòa tan 32 gam NaOH vô vào 400ml nước. Giải mến.
Lời giải :
Đổi: 400ml =0,4 lít
nNaOH = 32/80= 0,4 mol
Áp dụng công thức tính độ đậm đặc mol:
C%= ( CMxM)/(10xD)
Xem thêm: 8 Sản Phẩm Thuốc Bổ Trứng Tốt Nhất được Tin Dùng | IKute
Trong đó:
CM=n
V=0,8:0,4= 2M
Tính độ đậm đặc mol của 5 lít hỗn hợp sở hữu chứa chấp 0,5 mol NaCl.
Lời giải:
Nồng phỏng mol sẽ tiến hành tính như sau:
CM = 0,5/5 = 0,1M
Bài tập dượt 3 : Tính độ đậm đặc mol của hỗn hợp Khi hòa tan 15,8g KMnO4 vô 5 lít nước.
Lời giải:
Số mol của KMnO4 là: nKMnO4 = 15,8/158 =0,1 (mol)
Nồng phỏng mol của dung dịch: CM = 0,1/5 =0,02M
Bài tập dượt 4: Trong 100ml hỗn hợp sở hữu hòa tan 8 gam NaOH. Tính độ đậm đặc mol của hỗn hợp.
Lời giải :
Ta sở hữu V = 100ml = 0,1 lít
nNaOH = 8/40 = 0,2 mol
Áp dụng công thức bên trên tao có:
CM = n/V =0,2/0,1= 2M
Bài tập dượt 5: Hòa tan không còn trăng tròn gam NaCl vô vào 40 gam nước. Hãy tính độ đậm đặc Xác Suất của hỗn hợp này.
Lời giải:
Ta sở hữu lượng hỗn hợp là: mdd = mct + mdm = trăng tròn + 40 = 60 gam
Vậy độ đậm đặc Xác Suất hỗn hợp là: C%= x 100% = x 100%= 33,3 %.
Kết luận: Vậy độ đậm đặc hỗn hợp của NaCl là 33,3%.
Bài tập dượt 6: Hoà tan 10 gam lối vô 40 gam nước. Hãy tính độ đậm đặc Xác Suất của hỗn hợp nhận được.
Lời giải:
Ta sở hữu lượng hỗn hợp là: mdd = mct + mdm = 10 + 40 = 50 gam
Xem thêm: Tổng Hợp Những Mẫu Thảm Hội Trường | KHO THẢM TRẢI SÀN
Vậy độ đậm đặc Xác Suất hỗn hợp là: C%= x 100% = x 100%= trăng tròn %.
Kết luận: Vậy độ đậm đặc hỗn hợp của lối là 20%
Sau Khi phát âm kết thúc nội dung bài viết của Shop chúng tôi rất có thể hùn chúng ta ghi nhớ được công thức tính số mol, độ đậm đặc mol và độ đậm đặc Xác Suất nhằm áp dụng vô thực hiện bài bác tập dượt đúng chuẩn nhé













Bình luận